|
||||
|
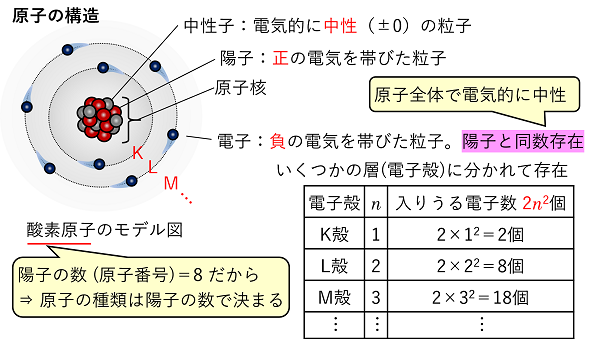
0 水素イオンH+と水酸化物イオンOH- 【原子の構造と電子配置】 原子の構造 原子は陽子(+の電気をもった粒子)と中性子(電気的に中性の粒子)からなる原子核と電子(-の電気をもった粒子)から構成される。原子は,その原子が持つ陽子の数(原子番号)と同じ数だけ電子をもっている。原子の電子は,原子核の周りにいくつかの層(電子殻)に分かれて存在する。電子殻は原子核に近い方(内側)からK殻,L殻,M殻,…とアルファベット順によばれ,より外側の電子殻ほど多くの電子を収容できる。各電子殻に入り得る電子数は,K,L,M,…をそれぞれn=1,2,3,…とすると,2n2個まで収容できる。 |
||||
 |
||||
|
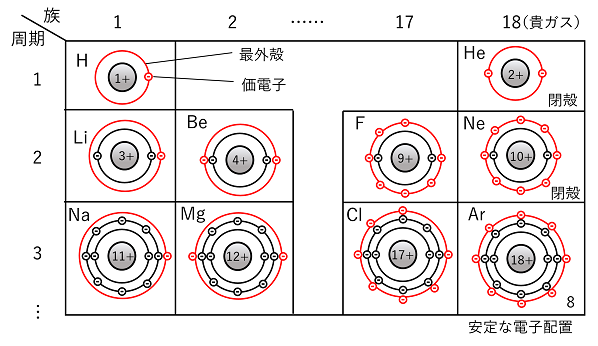
価電子と安定な電子配置 原子の最外殻の電子を価電子という。最外殻の電子は,原子が反応したり,結合したりするときに使われる。そのため,価電子の数が同じ原子は化学的性質が似る。 貴ガス(2He,10Ne,18Ar,36Kr,…)の原子は安定で,他の原子と反応したり,結合したりしない。貴ガスの最外殻を見ると閉殻(最大数の電子で満たされている状態)か電子数8の状態である。これより,安定な電子配置とは最外殻が閉殻か8個であることが分かる。 |
||||
 |
||||
|
問 次の原子の電子配置を例にならって示せ。 例) O K2 L6 (1) N (2) P (3) Al (4) Ca |
||||
 |
||||
|
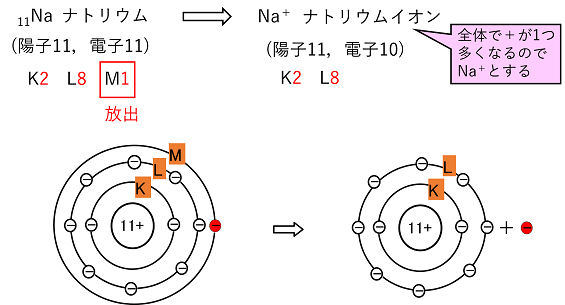
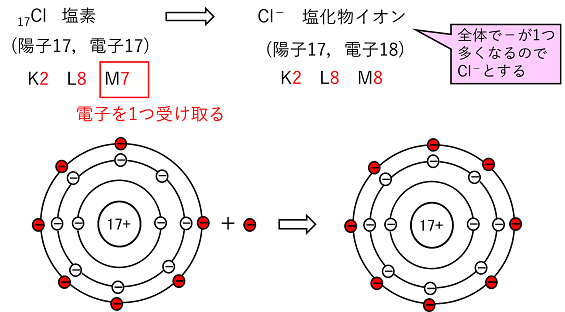
【イオンの生成】 陽イオンと陰イオンの生成 貴ガス以外の原子は,安定化するために最外殻の電子を放出したり,最外殻に電子を取り込んだりして安定な電子配置になる。原子が価電子をやり取りして安定化した粒子がイオンである。 例えばナトリウム11Naは電子が11個あるので,その電子配置はK2,L8,M1となる。この場合,最外殻(M殻)の1個の電子を放出すると,L殻が最外殻となり8で安定化する。その結果,電子(-の粒子)が1つ減り,全体で+1となるのでNa+と表す。このような+のイオンを陽イオンという。原則的に価電子が1~3の原子(金属原子)は陽イオンになる。 一方,塩素17Clは電子が17個あるので,その電子配置はK2,L8,M7となる。この場合,最外殻(M殻)に電子を1個取り込むと,最外殻(M殻)が8となり安定化する。その結果,電子が1つ増え,全体で-1となるのでCl-と表す。このような-のイオンを陰イオンという。原則的に価電子が6,7の原子(非金属原子)は陰イオンになる。 |
||||
|
||||
|
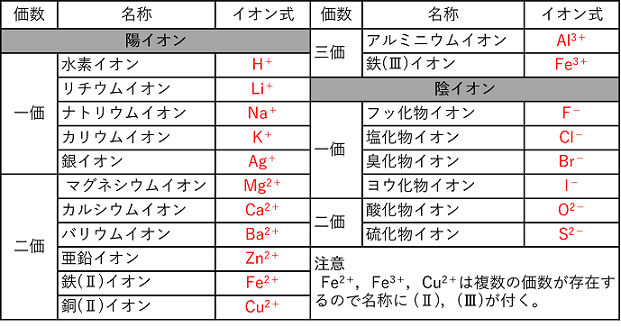
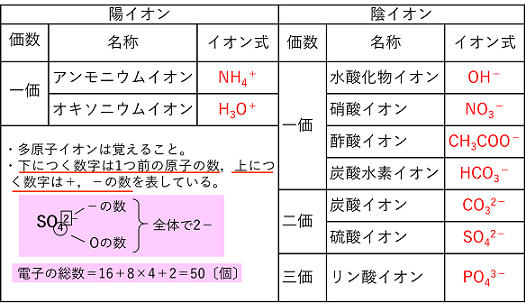
【主なイオンとイオン結合】 主なイオン イオンには原子1個からなる単原子イオンと複数の原子からなる多原子イオンがある。 |
||||
|
||||
|
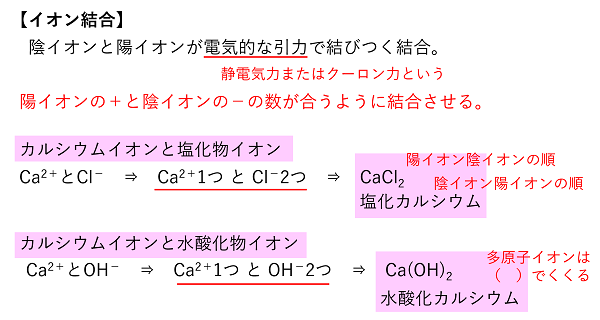
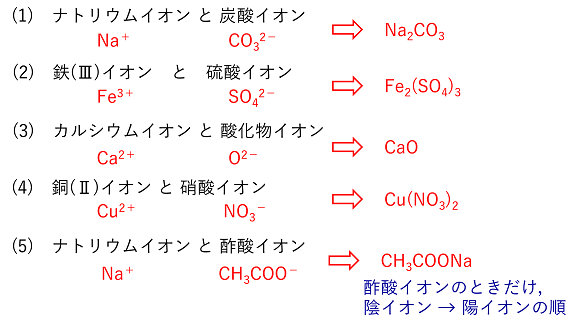
【イオン結合とイオンからなる物質】 イオン結合 陽イオンと陰イオンは,電気的な力(静電気力またはクーロン力という)によって結合する。これをイオン結合という。陽イオンと陰イオンは+と-の数が合うように結合する。 問 次のイオンからなる物質を化学式で書け。 (1) 炭酸ナトリウム (2) 硫酸鉄(Ⅲ) (3) 酸化カルシウム (4) 硝酸銅(Ⅱ) (5) 酢酸ナトリウム |
||||
|
||||
|
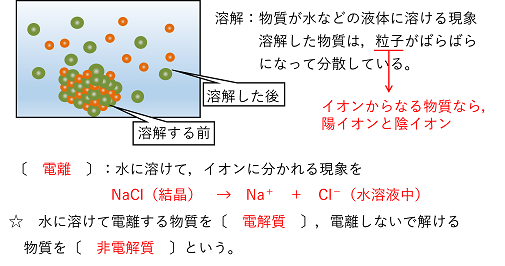
【電離】 結晶を水などの溶媒に溶かすと,結晶を構成する粒子はばらばらになって分散する。 |
||||
 |
||||
|
NaClなどのイオンからなる物質は,水に溶かすと水溶液中でNa+とCl-に分かれて存在している。Na+とCl-は電気的な引力により結合しているが,それぞれ単独でも安定に存在できる。また,より広がって(拡散して)いる方がエネルギー的に安定なので,NaClは水に溶かすとイオンに分かれる。このように物質がイオンに分かれることを電離という。また,NaClのように電離することができる物質を電解質という。一方,分子からなる物質など,電離しないで溶解する物質を非電解質とう。 問 物質の電離を化学反応式で示せ。 (1) NaOH (2) K2SO4 (3) NH4Cl (1) NaOH → Na+ + OH- (2) K2SO4 → 2K+
+ SO42- (3) NH4Cl → NH4+
+ Cl- |
||||
|
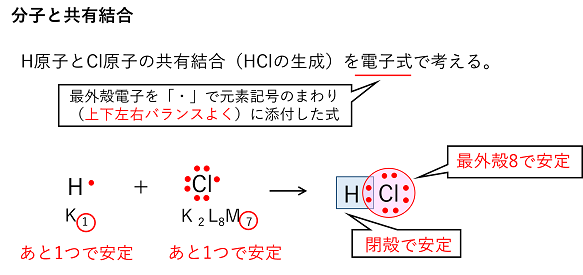
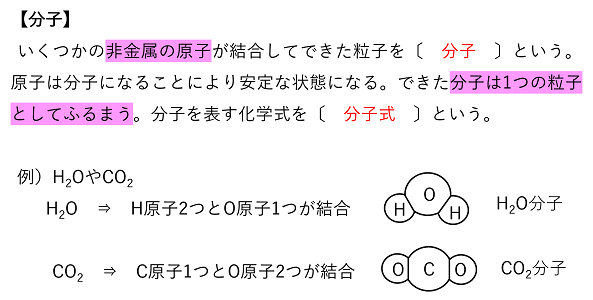
【分子と共有結合】 分子と共有結合 共有結合は非金属の原子どうしが互いの価電子を出し合って(共有して)結合し,互いに安定な電子配置になる結合である。また,その結果生じる新たな粒子を分子という。 |
||||
 |
||||
|
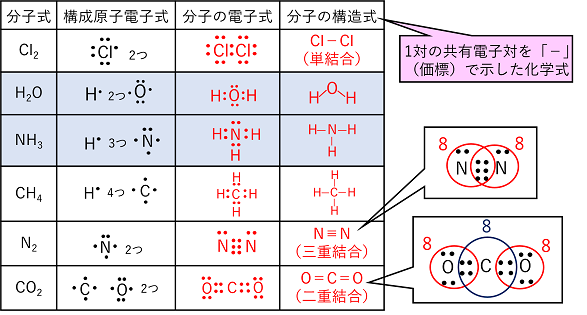
例)H原子とCl原子の共有結合(HCl分子の生成) 電子式(価電子だけを元素記号の周りに「・」で示した化学式)で考える 問 水H2OとアンモニアNH3を電子式で示せ。 |
||||
|
||||
|
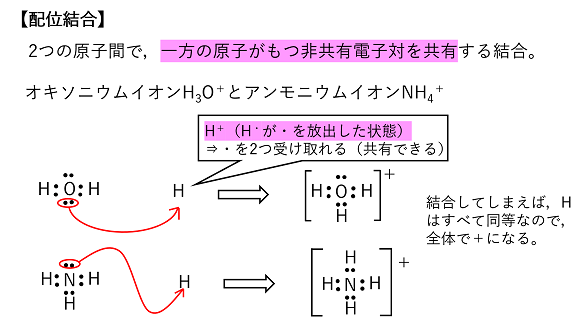
配位結合 水素イオンH+は水H2O分子やアンモニア分子NH3と結合し,オキソニウムイオン H3O+やアンモニウムイオンNH4+となる。この結合は,水素イオンH+(空のK殻が存在)がH2OやNH3の非共有電子対を共有する結合である。このように一方の原子がもつ非共有電子対を共有することによってできる共有結合を配位結合という。 |
||||
 |
||||
|
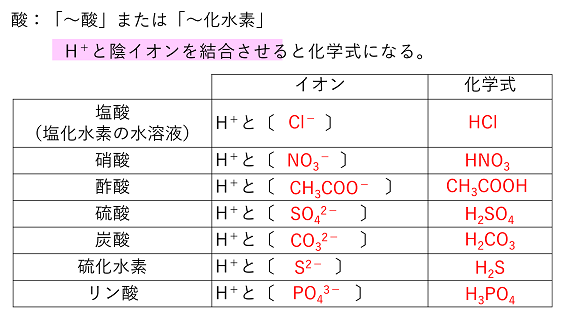
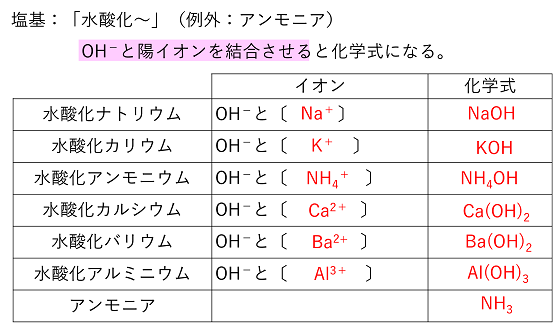
【酸と塩基で使う物質】 |
||||
|
||||
|
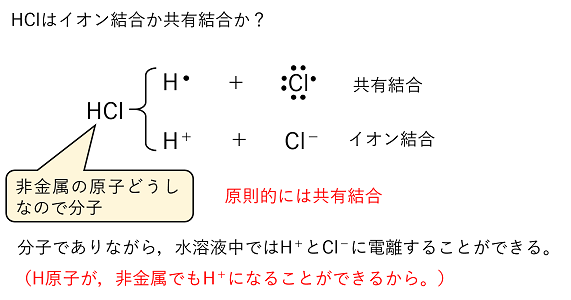
HClはイオン結合か共有結合か? HClは非金属の原子からなるので,原則的に共有結合によってできる分子である。しかし,H+とCl-のイオン結合とも考えることができる。実際に,HClは水に溶かすとH+とCl-に電離する。これは,「~酸」と呼ばれる物質の特徴で,分子(共有結合からなる物質)でありながらイオンからなる物質のようにH+と「~酸イオン」に電離することができるのである。このような特徴がみられるのは,H原子が非金属の原子でも,H+という陽イオンになるためである。 一方,塩基と呼ばれる物質の多くは「水酸化~」という物質で,これらは陽イオンと水酸化物イオンOH-とのイオン結合による物質である。 |
||||
 |
||||
 |